Bệnh phụ khoa
Xơ vữa động mạch: Nguyên nhân, triệu chứng, cách điều trị
Xơ vữa động mạch là gì?
Xơ vữa động mạch (atherosclerosis) là một tình trạng mạn tính trong đó các động mạch cứng lại do sự tích tụ của các mảng xơ vữa. Bệnh là nguyên nhân chính gây tử vong ở các nước phát triển. Thuật ngữ “atherosclerosis” bắt nguồn từ tiếng Hy Lạp, có nghĩa là lớp nội mạc động mạch dày lên và tích tụ chất béo. Bản thân thuật ngữ này gồm hai phần: “vữa” (sự tích tụ chất béo kèm theo đại thực bào) và “xơ” (lớp xơ hóa bao gồm các tế bào cơ trơn, bạch cầu và mô liên kết), trong đó quá trình vữa xảy ra trước quá trình xơ.
Dịch tễ
Rất khó xác định chính xác tỷ lệ mắc xơ vữa động mạch do bệnh thường không có triệu chứng. Xơ vữa động mạch là nguyên nhân chính của các bệnh tim mạch. Bệnh tim mạch do xơ vữa chủ yếu liên quan đến tim và não: bệnh tim thiếu máu cục bộ và đột quỵ do thiếu máu cục bộ. Bệnh tim thiếu máu cục bộ và đột quỵ lần lượt là các nguyên nhân gây tử vong đứng thứ nhất và thứ năm trên thế giới.
Tại Hoa Kỳ, khoảng 610,000 người chết mỗi năm vì bệnh tim. Điều này tương đương với cứ bốn ca tử vong thì có một ca là do bệnh tim gây ra. Bệnh mạch vành là nguyên nhân gây tử vong hàng đầu ở các nước phương Tây với hơn 370,000 người chết mỗi năm. Trung bình khoảng 735,000 người Mỹ bị đau tim mỗi năm. Trong số này, 525,000 trường hợp là đau tim lần đầu và 210,000 trường hợp là tái phát. 75% các trường hợp nhồi máu cơ tim cấp xảy ra do vỡ mảng xơ vữa và tỷ lệ cao nhất thuốc về quần thể nam giới trên 45 tuổi, trong khi đó ở phụ nữ, tỷ lệ mắc bệnh tăng lên sau 50 tuổi. Tỷ lệ xơ vữa động mạch ở nam giới cao hơn nữ giới có thể là do sự bảo vệ của hormone sinh dục nữ.
Đột quỵ do bất kỳ nguyên nhân nào là nguyên nhân gây tử vong đứng thứ năm trên thế giới và là nguyên nhân chính gây tàn tật nghiêm trọng lâu dài cho người trưởng thành tại Mỹ. Theo báo cáo, có khoảng 795,000 ca đột quỵ mỗi năm ở Mỹ, dẫn đến khoảng 140,323 ca tử vong. Đột quỵ do thiếu máu cục bộ là dạng tồn tại chính của các ca đột quỵ này.
Nguyên nhân và yếu tố nguy cơ
Nguyên nhân và các yếu tố nguy cơ chính xác của xơ vữa động mạch vẫn chưa được biết rõ. Các yếu tố nguy cơ quan trọng của bệnh có thể kể đến bao gồm:
Rối loạn nồng độ cholesterol và lipoprotein máu: Đây là yếu tố nguy cơ quan trọng nhất của xơ vữa động mạch. Nồng độ cholesterol và các loại lipoprotein lí tưởng trong máu:
- Cholesterol tổng ≤ 5 mmol/L
- Tỷ lệ cholesterol/HDL ≤ 4
- LDL cholesterol ≤ 3 mmol/L
- HDL cholesterol ≥ 1 mmol/L
- HDL: lipoprotein tỷ trọng cao; LDL: lipoprotein tỷ trọng thấp.
Tăng huyết áp: Thông thường huyết áp được coi là cao khi ≥ 140/90 mmHg. Nếu bệnh nhân có đái tháo đường hoặc bệnh thận mạn, huyết áp cao được định nghĩa là ≥ 130/80 mmHg.
Hút thuốc lá: Hút thuốc lá có thể gây thiếu oxy mô. Hút thuốc lá đồng thời cũng gây phá hủy và co thắt mạch máu, tăng cholesterol máu và tăng huyết áp.
Kháng insulin và đái tháo đường: Cơ thể người bệnh không thể sử dụng glucose làm năng lượng dẫn đến tăng cường ly giải lipid để sinh năng lượng. Điều này lại gây ra rối loạn lipid máu.
Thừa cân hoặc béo phì: Các tình trạng này là yếu tố nguy cơ tiềm ẩn của kháng insulin và đái tháo đường type 2 cũng như tăng huyết áp và rối loạn lipid máu.
Ít hoạt động thể chất: Lối sống tĩnh tại, lười vận động là yếu tố nguy cơ của thừa cân và béo phì, tăng huyết áp, đái tháo đường…
Chế độ ăn uống không lành mạnh: Chế độ ăn giàu chất béo bão hòa (mỡ động vật) hoặc chất béo chuyển hóa transfat (bơ thực vật), cholesterol (lòng đỏ trứng, mỡ động vật), muối và đường có thể làm trầm trọng hơn các yếu tố nguy cơ khác của xơ vữa động mạch.
Tuổi cao: Các yếu tố di truyền và lối sống gây tích tụ mảng xơ vữa động mạch theo tuổi. Nguy cơ tăng lên sau 45 tuổi với nam và sau 55 tuổi với nữ.
Tiền sử gia đình mắc bệnh tim mạch sớm: Nguy cơ tim mạch của bệnh nhân tăng lên khi bố hoặc anh/em trai được chẩn đoán bệnh tim mạch trước 55 tuổi, hoặc nếu mẹ hoặc chị/em gái được chẩn đoán bệnh tim mạch trước 65 tuổi.
Quá trình viêm: Viêm là đáp ứng của cơ thể với tổn thương hoặc nhiễm trùng. Sự phá hủy thành trong động mạch do viêm có thể giúp cho mảng xơ vữa phát triển.
Nồng độ CRP (protein phản ứng C) cao: Nồng độ CRP cao là một dấu hiệu của quá trình viêm và có thể phát triển xơ vữa động mạch ở tỷ lệ cao hơn.
Tăng triglyceride máu: Tăng triglyceride máu cũng là một yếu tố nguy cơ của xơ vữa động mạch, đặc biệt là ở phụ nữ.
Ngưng thở khi ngủ: Chứng ngưng thở khi ngủ không được điều trị có thể làm tăng nguy cơ tăng huyết áp, đái tháo đường, đau tim hoặc đột quỵ.
Stress: Nguyên nhân gây khởi phát cơn đau tim phổ biến nhất là một cú sốc về cảm xúc, đặc biệt là tức giận.
Đồ uống chứa cồn: Sử dụng nhiều đồ uống chứa cồn có thể gây phá hủy cơ tim và làm trầm trọng hơn các yếu tố nguy cơ của xơ vữa động mạch.
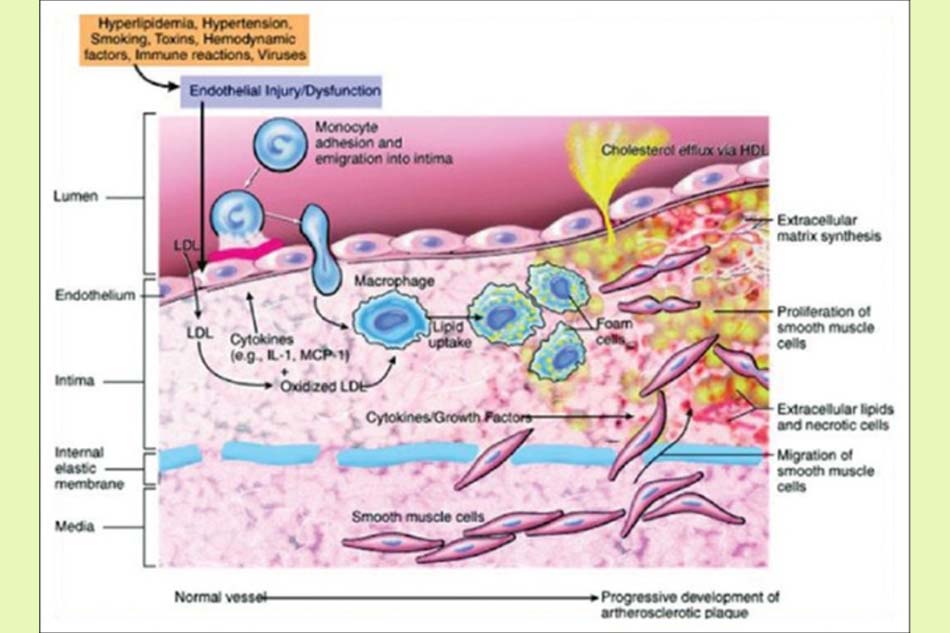
Cơ chế bệnh sinh
Hình thành vệt mỡ:
Hình thành vệt mỡ là dấu hiệu đầu tiên của xơ vữa động mạch. Các tổn thương ban đầu thường do sự gia tăng khu trú các lipoprotein ở lớp nội mạc động mạch.
Các hạt lipoprotein bao gồm protein, phospholipid, cholesterol và triglyceride. LDL là lipoprotein chịu trách nhiệm chính trong xơ vữa động mạch. LDL có thể được tích lũy ở nội mạc mạch máu do khả năng thâm nhập vào nội mạc hoặc bám vào các thành phần chất nền ngoại bào như proteoglycan.
Tại vị trí tổn thương, có sự mất cân bằng giữa các thành phần khác nhau của chất nền. Ví dụ, trong số ba nhóm chính của proteoglycan, sự gia tăng tương đối của các phân tử heparin sulfate so với keratan sulfate và chondroitin sulfate có thể gây ra kết dính các lipoprotein và hình thành vệt mỡ.
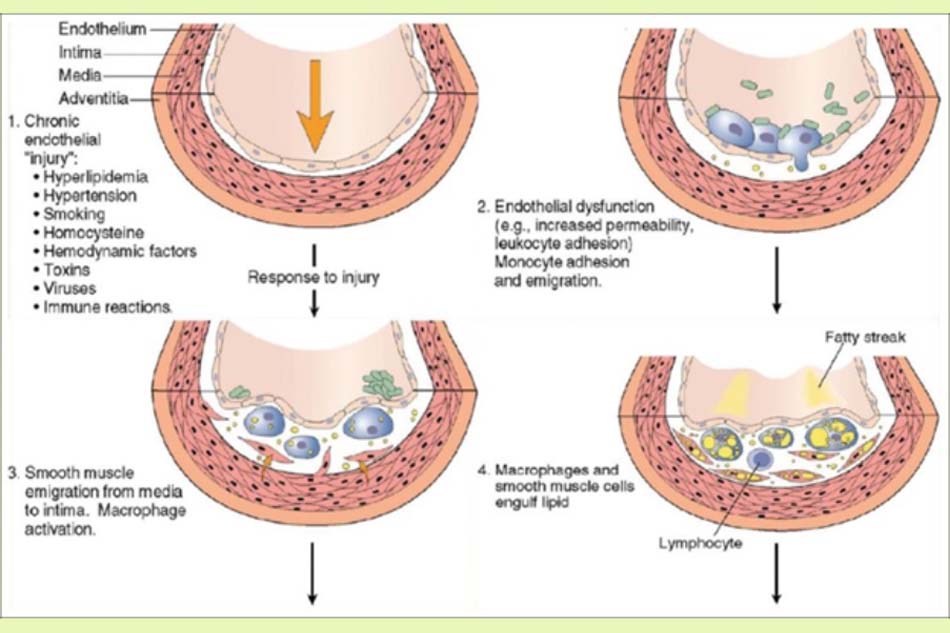
Quá trình hình thành vệt mỡ gồm bốn bước:
- Bẫy LDL-C: Bước đầu tiên trong quá trình hình thành xơ vữa là giữ lại lipoprotein ở vị trí tổn thương. Mặc dù LDL-C không thể đi qua các điểm nối nội mô chắc chắn, nhưng nó có thể nhanh chóng đi vào trong các tế bào nội mô thông qua quá trình nhập bào.
Trong điều kiện bình thường, có sự cân bằng giữa nồng độ LDL huyết tương và LDL nội bào của thành động mạch. Đi cùng với nồng độ lipid huyết tương tăng, nhiều phần tử trong số này bị bẫy trong nội mạc (do các proteoglycan ngoại bào tăng lên có ái lực cao với LDL). Do có sự tương quan trực tiếp giữa nồng độ LDL huyết tương và lượng lipoprotein trong tổn thương, nồng độ LDL huyết tương có thể được coi là một chỉ báo cho sự hình thành xơ vữa.
Bẫy LDL dẫn đến tăng nồng độ LDL trong nội mạc cũng như tăng thời gian lưu lại tổn thương của chúng.
- Hoạt hóa các tế bào nội mô: Cytokine và lipid bị oxy hóa đóng vai trò quan trọng trong hoạt hóa các tế bào nội mô. Trong giai đoạn đầu của quá trình xơ vữa động mạch, bạch cầu đơn nhân và tế bào lympho T thâm nhập vào nội mạc mạch máu.
Bạch cầu đơn nhân được biệt hóa thành đại thực bào, chúng thực bào các lipid bị oxy hóa (ví dụ: Ox-LDL) và hình thành các tế bào bọt. Ox-LDL đóng vai trò trong hoạt hóa tế bào lympho T và hoạt động như một kháng nguyên cho tế bào này. Do đó, tế bào lympho T tiết ra các cytokine để hoạt hóa các đại thực bào và làm thay đổi các tế bào nội mô và cơ trơn.
- Hoạt hóa bạch cầu: Trong những giai đoạn đầu tiên của quá trình xơ vữa động mạch, bạch cầu đơn nhân và tế bào lympho T xâm nhập vào nội mạc nguyên vẹn. Quá trình này cần sự biểu hiện của các phân tử kết dính bạch cầu và chemokine, trong đó quá trình phiên mã được thực hiện bởi yếu tố NF-αβ. Yếu tố này là một yếu tố phiên mã và được hoạt hóa khi các cytokine tiền viêm gắn với các thụ thể của chúng trên bề mặt nội mô.
Các phân tử kết dính bạch cầu có liên quan đến các giai đoạn chính của xơ vữa động mạch. Tế bào nội mô là nguồn quan trọng để sản xuất các phân tử này.
Thụ thể của các phân tử kết dính được biểu hiện trên bạch cầu đặc hiệu, tế bào cơ trơn hoặc tế bào nội mô mạch máu. Các phân tử kết dính này có vai trò quan trọng trong sản xuất và giải phóng các phân tử gây hóa ứng động bạch cầu và/hoặc chemokine. Chemokine là các protein hoặc cytokine gây hóa ứng động bạch cầu có trọng lượng phân tử thấp (8-10 kDa), có vai trò quan trọng trong hoạt hóa và di chuyển của bạch cầu.
Các chemokine đặc hiệu cũng có thể khiến cho các tế bào nội mô và cơ trơn di chuyển. Các nghiên cứu đã chứng minh được trong những giai đoạn đầu tiên của xơ vữa động mạch, protein chemokine bạch cầu đơn nhân (MCP-1) ức chế được biểu hiện đáng kể ở đại thực bào và một phần nhỏ hơn ở các tế bào cơ trơn và nội mô. Sự tăng cường này là kết quả của tăng cholesterol trong chế độ ăn, làm cho các bạch cầu đơn nhân di chuyển về phía thành mạch và xâm nhập vào tổn thương. MCP-1 được biểu hiện trong tất cả các giai đoạn của xơ vữa động mạch.
Ox-LDL điều hòa lên các phân tử kết dính. Nó cũng biểu hiện mRNA MCP trong tế bào nội mô và cơ trơn nhờ lysophosphatidylcholine, kết quả của chức năng của phospholipase A2 trên LDL.
- Hình thành các tế bào bọt: Các bạch cầu đơn nhân biệt hóa thành đại thực bào sau khi được chèn vào lớp nội mạc. Thực bào lipid có thể ngăn ngừa xơ vữa động mạch. Một số đại thực bào tích lũy lipid có thể lấy lipid ra khỏi động mạch. Nếu nồng độ lipid đi vào thành động mạch nhiều hơn đi ra (bằng thực bào hoặc các con đường khác), điều này sẽ dẫn đến tích tụ lipid và hình thành mảng xơ vữa.
Khi các đại thực bào thực bào Ox-LDL nhờ thụ thể đặc biệt, chúng trở thành các tế bào bọt. Sự biểu hiện của các thụ thể này tăng lên trong quá trình biệt hóa bạch cầu đơn nhân thành đại thực bào bởi các cytokine và lipid bị oxy hóa. Sự biểu hiện của chúng cũng được tạo điều kiện thuận lợi bởi yếu tố kích thích quần thể bạch cầu hạt – đại thực bào (GM-CSF). Sự tích tụ của các tế bào bọt trên thành động mạch dẫn đến hình thành các vệt lipid.
Một số tế bào bọt trong các tổn thương nội mô tiến triển chết theo chương trình (quá trình apoptosis). Quá trình này làm cho nhân hoại tử giàu lipid ở trung tâm mảng xơ vữa động mạch phát triển hơn. Bạch cầu đơn nhân ngoài tạo ra các tế bào bọt còn có thể tạo ra các chất độc tế bào như yếu tố hoại tử khối u (TNF), yếu tố tăng trưởng, chất tiền đông máu (bao gồm cả yếu tố mô) và các gốc tự do. Những chất này có thể gây ra tổn thương nhiều hơn cho lớp nội mạc cũng như oxy hóa LDL nhiều hơn, dẫn đến nhiều thay đổi trong chuyển hóa.
Hình thành mảng vữa:
Tổn thương mô mạch máu nghiêm trọng xảy ra khi các tế bào cơ trơn và nội mô lân cận tiết ra các peptide nhỏ như các cytokine và yếu tố tăng trưởng như interleukin 1 (IL-1) và TNF. Những yếu tố này làm cho tế bào cơ trơn di chuyển vào phía trong lòng mạch. Trong điều kiện này, sự di chuyển của tế bào cơ trơn và chất nền ngoại bào được tổng hợp tạo thành đỉnh xơ. Đỉnh xơ bao gồm các mô sợi giàu collagen, tế bào cơ trơn, đại thực bào và tế bào lympho T. Tất cả chúng tạo thành mảng xơ vữa và phình ra trong lòng mạch, cản trở đường đi của máu trong lòng mạch.
Các đại thực bào và tế bào lympho T được tìm thấy trong đường biên của mảng vữa đã phát triển. Các đại thực bào tiết ra meta proteinase, góp phần vào quá trình ly giải chất nền ngoại bào. Tế bào T sản xuất TNF-α ngăn cản quá trình tổng hợp collagen trong tế bào cơ trơn.
Các quá trình này làm yếu đỉnh xơ và có thể phá hủy nó. Sự phá hủy nó làm lộ ra collagen và lipid, hoạt hóa dòng thác đông máu thông qua kết dính các tiểu cầu và hình thành cục máu đông, có thể gây tắc nghẽn đột ngột dòng máu.
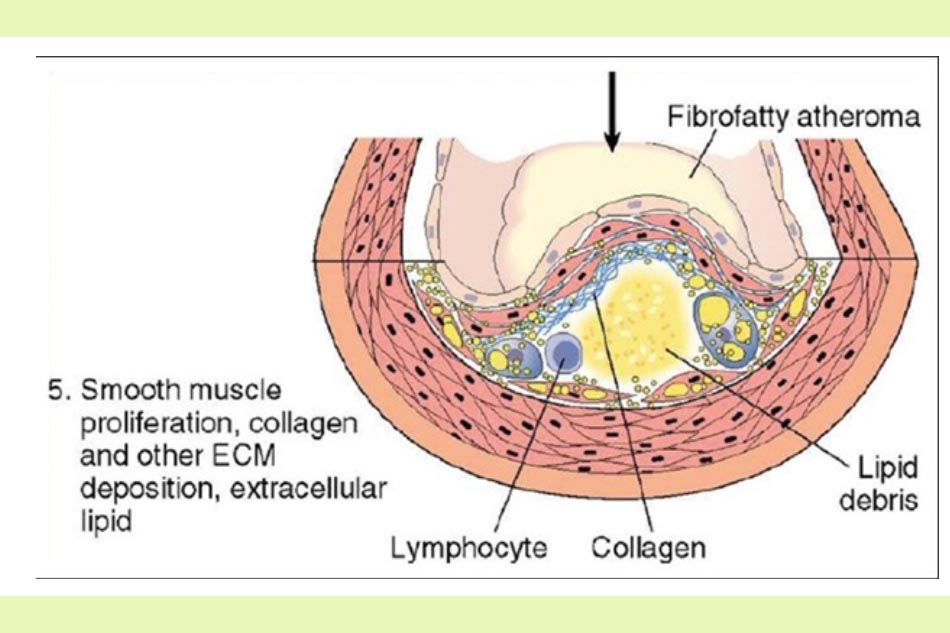
Hình thành mảng xơ vữa động mạch
Các thành phần cấu tạo nên mảng xơ vữa bao gồm:
- Nội mô mạch máu: Nội mô mạch máu phản ứng với các đại phân tử và thành phần của máu để tăng chuyển protein trong huyết tương.
- Cơ trơn động mạch: Việc duy trì sửa chữa mạch máu, sự chuyển hóa các sản phẩm máu bao gồm lipid và sự bài tiết các cytokine khác nhau là cần thiết trong để kiểm soát trương lực thành mạch.
- Bạch cầu: Chúng có thể tham gia vào đáp ứng miễn dịch. Lõi của mảng xơ vữa bao gồm các tế bào tổn thương, tế bào bọt, calci, cholesterol ester và một phần chất béo. Nhân lipid là một khối màu có màu vàng nhạt do sắc tố carotenoid tạo nên.
Triệu chứng
Xơ vữa động mạch nhẹ thường không có bất kỳ triệu chứng nào. Bệnh nhân thường sẽ không có triệu chứng cho đến khi động mạch bị tắc nghẽn hoặc thu hẹp đến mức không thể cung cấp đủ máu cho các mô và cơ quan.
Các triệu chứng của xơ vữa động mạch từ trung bình đến nặng phụ thuộc vào động mạch bị ảnh hưởng. Cụ thể:
- Nếu xơ vữa xảy ra ở động mạch vành, bệnh nhân sẽ có đau thắt ngực. Triệu chứng đau thắt ngực có thể là điển hình hoặc không điển hình, bệnh nhân có thể cảm thấy như có vật nặng đè lên ngực, khó thở, bóp nghẹt, triệu chứng có thể giống như trào ngược dạ dày – thực quản…
- Nếu xơ vữa xảy ra ở động mạch dẫn máu lên não, bệnh nhân có thể có các dấu hiệu và triệu chứng như đột ngột tê hoặc yếu ở tay hoặc chân, khó nói hoặc nói lắp, mất thị lực tạm thời ở một bên mắt hoặc cơ mặt xệ xuống… Những dấu hiệu này báo hiệu một cơn thiếu máu cục bộ thoáng qua, nếu không được điều trị, nó có thể tiến triển thành đột quỵ.
- Nếu xơ vữa xảy ra ở động mạch tay hoặc chân, bệnh nhân có thể có các dấu hiệu hoặc triệu chứng của bệnh động mạch ngoại vi, chẳng hạn như đau chân khi đi bộ (claudication) hoặc giảm huyết áp ở chi bị ảnh hưởng.
- Nếu xơ vữa xảy ra ở động mạch dẫn máu đến thận, bệnh nhân có thể bị tăng huyết áp hoặc suy thận.
Biến chứng
Biến chứng chính của xơ vữa động mạch là bệnh tim mạch do xơ vữa (ASCVD), có thể biểu hiện dưới dạng bệnh động mạch vành (CAD), bệnh mạch máu não (CVA), cơn thiếu máu cục bộ thoáng qua (TIA), bệnh động mạch ngoại vi (PAD), phình động mạch chủ bụng và hẹp động mạch thận ở nam giới.
Tiên lượng của bệnh tim mạch do xơ vữa rất tốt do những tiến bộ trong quản lý các yếu tố nguy cơ như giảm LDL-C bằng liệu pháp Statin, hạ huyết áp, điều trị đái tháo đường, cai thuốc lá, tập thể dục thường xuyên và tuân thủ chế độ ăn uống nghiêm ngặt. Tiên lượng xấu hơn trong suy tim, đột quỵ do thiếu máu cục bộ kèm theo tê liệt, suy giảm nhận thức, hoại thư đòi hỏi phải đoạn chi và phình vỡ động mạch chủ bụng.
Chẩn đoán
Bệnh nhân sẽ được khám thực thể (ví dụ: nghe tim, đo huyết áp) cũng như khai thác tiền sử bệnh của bản thân và gia đình.
Một số xét nghiệm cận lâm sàng có thể được tiến hành:
- Xét nghiệm máu: Xét nghiệm này chủ yếu đóng vai trò kiểm tra nồng độ đường huyết cũng như cholesterol và các loại lipoprotein trong máu. Đường huyết cao và cholesterol máu cao có liên quan đến nguy cơ xơ vữa động mạch. Nồng độ CRP cũng có thể được kiểm tra để xác định tình trạng viêm trong cơ thể.
- Điện tâm đồ (ECG): Đây là một xét nghiệm đơn giản và không xâm lấn giúp phát hiện sớm các bất thường về chức năng tim.
- Siêu âm tim: Đôi khi điện tâm đồ là không đủ nhạy để phát hiện các bất thường về tim, trong các trường hợp này, siêu âm tim là lựa chọn tốt hơn.
- Siêu âm Doppler: Phương pháp này giúp xác định mức độ tắc nghẽn cũng như tốc độ lưu thông máu trong động mạch.
- Chỉ số cổ chân – cánh tay (ABI): Xét nghiệm này có thể cho biết mức độ xơ vữa động mạch ở chân và bàn chân (so sánh huyết áp ở cổ chân và cánh tay, sự khác biệt bất thường có thể là dấu hiệu của bệnh mạch máu ngoại vi, thường do xơ vữa động mạch).
- Đặt ống thông tim và chụp mạch: Xác định động mạch vành bị thu hẹp hoặc tắc nghẽn thông qua chụp X-quang (sử dụng thuốc cản quang).
- Chụp cắt lớp vi tính (CT) đánh giá vôi hóa mạch vành: Phương pháp này có thể cho thấy sự vôi hóa thành động mạch. Khi có vôi hóa, điểm càng cao thì nguy cơ càng cao.
- Các xét nghiệm hình ảnh khác: Bệnh nhân có thể được chụp cộng hưởng từ mạch máu (MRA) hoặc chụp cắt lớp phát xạ positron (PET). Các xét nghiệm này có thể cho thấy tình trạng xơ cứng và hẹp của các động mạch lớn, cũng như chứng phình động mạch.
Điều trị
Điều trị không dùng thuốc
Điều trị không dùng thuốc hay thay đổi lối sống là biện pháp bắt buộc mà mọi bệnh nhân phải tuân thủ, mặc dù thông thường chỉ áp dụng biện pháp này là không đủ để kiểm soát bệnh.
- Chế độ ăn uống: Ăn nhiều rau xanh, hoa quả tươi để cung cấp đầy đủ các vitamin và khoáng chất. Ăn thịt nạc, hạn chế mỡ động vật, ưu tiên thịt trắng và hải sản hơn thịt đỏ. Hạn chế ăn lòng đỏ trứng. Sử dụng các loại thực phẩm giàu chất béo không bão hòa đa (giàu omega 3) như cá hồi, cá ngừ… Sử dụng chất béo tốt từ lạc, vừng, dầu oliu, dừa… thay cho các dầu ăn công nghiệp, bơ thực vật. Hạn chế tiêu thụ các loại thực phẩm chứa nhiều đường, đặc biệt là đường dễ hấp thu như bánh kẹo, đồ ngọt, nước uống có gas… Hạn chế rượu bia.

- Chế độ vận động: Người bệnh cần vận động thể chất thường xuyên để cải thiện tình trạng bệnh, tối thiểu 150 phút mỗi tuần với cường độ tập luyện trung bình hoặc tập luyện phù hợp với sức khỏe của bản thân.
- Cai thuốc lá.
- Không thức khuya, hạn chế tối đa các cảm xúc tiêu cực.
Điều trị dùng thuốc
Ở đây chúng ta chỉ nói đến các thuốc giúp điều trị rối loạn lipid máu, nguyên nhân quan trọng nhất của xơ vữa động mạch. Tùy theo bệnh mắc kèm mà bệnh nhân cần sử dụng bổ sung các thuốc điều trị tăng huyết áp, đái tháo đường, suy thận…
Liệu pháp giảm LDL-C:
- Thuốc ức chế HMG-CoA reductase (Statin): Các thuốc ức chế enzyme 3-hydroxy-3-methyl-glutaryl-coenzyme A (HMG-CoA) reductase, thường được gọi dưới cái tên “Statin”, là nhóm thuốc được sử dụng phổ biến nhất trong điều trị xơ vữa động mạch. Thông qua ức chế enzyme HMG-CoA reductase, các Statin làm tăng biểu hiện của các thụ thể LDL trên bề mặt tế bào gan, từ đó làm tăng hấp thu LDL từ trong máu vào tế bào gan, làm giảm nồng độ LDL-C và các lipoprotein chứa apoB khác trong máu, bao gồm cả các hạt giàu triglyceride. Thuốc cũng làm cản trở sự giải phóng của VLDL (lipoprotein tỷ trọng rất thấp) từ gan vào máu.
Từ những năm 1990, các thuốc này đã cho thấy hiệu quả bảo vệ tim mạch tốt trong nhiều thử nghiệm lâm sàng lớn. Các phân tích tổng hợp cho thấy cứ giảm 1 mmol/L LDL-C thì nguy cơ biến cố tim mạch giảm 22%, bất kể nồng độ LDL-C và nguy cơ tim mạch ban đầu.
Tác dụng không mong muốn điển hình của Statin là chúng có thể gây ra tình trạng gan nhiễm mỡ. Hiếm gặp hơn, một số bệnh nhân có thể gặp phải tình trạng tiêu cơ vân cấp (ly giải cơ vân cấp), một tình trạng nguy hiểm và có thể dẫn đến suy thận cấp và tử vong. Nguy cơ này tăng lên cùng với nồng độ thuốc trong máu.
Đa số các Statin được chuyển hóa qua enzyme CYP3A4 ở gan, vì vậy phối hợp Statin với một số thuốc ức chế mạnh CYP3A4 có thể làm tăng cao nồng độ Statin trong máu, tăng nguy cơ gặp phải tiêu cơ vân cấp. Một số phối hợp là chống chỉ định, ví dụ: Simvastatin + Clarithromycin.
Các Statin đa phần sẽ được dùng trước khi đi ngủ do quá trình tổng hợp cholesterol tại gan diễn ra mạnh nhất về đêm. Atorvastatin có thời gian bán thải dài nên có thể được sử dụng vào buổi sáng.
- Thuốc ức chế hấp thu cholesterol: Thuốc đại diện cho nhóm này là Ezetimibe. Trong các thử nghiệm lâm sàng, đơn trị liệu bằng Ezetimibe làm giảm LDL-C 15-22%. Các tác dụng không mong muốn là không đáng kể. Kết quả từ các nghiên cứu PRECISE-IVUS và IMPROVE-IT ủng hộ việc sử dụng Ezetimibe như liệu pháp bậc hai kết hợp với Statin khi không đạt được mục tiêu điều trị với liều Statin dung nạp tối đa, hoặc bệnh nhân không dung nạp Statin, hoặc những bệnh nhân có chống chỉ định với Statin.
- Nhựa gắn acid mật: Với liều tối đa, Cholestyramine, Colestipol hoặc Colesevelam (thuốc mới nhất trong nhóm này) có thể làm giảm LDL-C 18-25%. Việc sử dụng Cholestyramine và Colestipol bị hạn chế bởi các tác dụng không mong muốn trên đường tiêu hóa cũng như khả năng tương tác với nhiều loại thuốc khác (làm giảm sinh khả dụng của nhiều thuốc). Colesevelam dường như được dung nạp tốt hơn và ít tương tác thuốc hơn. Nó có thể được kết hợp với Statin. Có tương đối ít bằng chứng từ các thử nghiệm lâm sàng lớn cho nhóm thuốc này.
- Thuốc ức chế PCSK9 (Proprotein Convertase Subtilisin/Kexin type-9): Các thuốc ức chế PCSK9 mang lại triển vọng hạ LDL-C thậm chí còn tốt hơn kết hợp Statin và Ezetimibe. PCSK9 liên kết với thụ thể LDL trên bề mặt tế bào gan và kích thích sự thoái hóa các thụ thể này. Thông qua ức chế PCSK9, sự phân hủy thụ thể LDL bị ngăn chặn, do đó các thuốc này giúp cải thiện sự hấp thu của gan với LDL-C, dẫn đến giảm nồng độ LDL-C trong huyết tương.
Hai đại diện của nhóm thuốc này có bản chất kháng thể đơn dòng là Evolocumab và Alirocumab. Trong các thử nghiệm lâm sàng, các thuốc này làm giảm LDL-C khoảng 50%. Liệu pháp này phù hợp với các bệnh nhân còn biểu hiện thụ thể LDL, bao gồm cả tăng cholesterol máu gia đình đồng hợp tử và dị hợp tử. Việc sử dụng liệu pháp này còn hạn chế chủ yếu bởi giá thành thuốc cao.
Một thuốc khác cũng ức chế PCSK9 nhưng không phải kháng thể đơn dòng là Inclisiran (đã được phê duyệt tại châu Âu). Thuốc có bản chất là một phân tử RNA can thiệp nhỏ (siRNA). Các phân tử siRNA có khả năng kích hoạt phức hợp tắt gene kích ứng bởi RNA (RISC), phức hợp này phân cắt các phân tử RNA thông tin (mRNA) mã hóa đặc hiệu cho PCSK9. Khi không có mRNA, quá trình dịch mã không xảy ra và PCSK9 không được tổng hợp. Thử nghiệm ORION pha 2 cho thấy một liều tiêm dưới da 300 mg Inclisiran làm giảm LDL-C sau 6 tháng. Thuốc được dung nạp tốt và không có lo ngại về mức độ an toàn.
- Bempedoic acid: Thuốc này hoạt động theo cơ chế ức chế adenosine triphosphate citrate lyase (ACL). Thuốc ức chế sinh tổng hợp cholesterol và điều hòa lên thụ thể LDL, từ đó làm giảm nồng độ LDL huyết tương.
Liệu pháp giảm triglyceride:
- Statin: Statin cũng có tác dụng làm giảm triglyceride dù không mạnh. Lợi ích của việc giảm triglyceride huyết tương trong làm giảm các biến cố tim mạch còn khiêm tốn. Statin là liệu pháp được lựa chọn đầu tay ở bệnh nhân có tăng triglyceride máu vì chúng làm giảm nguy cơ tim mạch và ở liều cao, chúng có tác dụng mạnh hơn trên nồng độ triglyceride (giảm tới 27%).
- Fibrate: Các thuốc nhóm này là thuốc chủ vận thụ thể nhân PPAR-α (thụ thể hoạt hóa tăng sinh peroxisome-α), hoạt động thông qua các yếu tố phiên mã điều hòa các bước khác nhau trong quá trình chuyển hóa lipid và lipoprotein. Fibrate có hiệu lực tốt trong hạ triglyceride lúc đói cũng như triglyceride sau ăn và các hạt lipoprotein giàu triglyceride, với hiệu lực lên đến hơn 50%. Tuy nhiên, kết quả từ 5 thử nghiệm lâm sàng tiến cứu và 5 phân tích tổng hợp không chứng minh được kết quả tim mạch vượt trội của Fibrate, đặc biệt khi sử dụng cùng với Statin.
Các Fibrate cũng có thể gây ra tác dụng không mong muốn tiêu cơ vân cấp tương tự như Statin, đặc biệt nguy cơ này tăng cao khi phối hợp Fibrate với Statin.
- Acid béo omega-3: Acid béo omega-3 (eicosapentaenoic acid [EPA] và docosahexaenoic acid [DHA]) có thể làm giảm triglyceride thông qua tương tác với PPAR. Mặc dù cơ chế của chúng chưa được hiểu rõ, acid béo omega-3 có thể làm giảm nồng độ triglyceride lên đến 45%. Một phân tích tổng hợp bao gồm 20 nghiên cứu và 63,000 bệnh nhân đã không tìm thấy tác dụng tổng thể của acid béo omega-3 đối với các biến cố tim mạch. Acid béo omega-3 dường như an toàn và không tương tác với các thuốc khác.
Liệu pháp tăng HDL-C:
Cho đến nay, không có bằng chứng thuyết phục nào cho thấy việc tăng HDL-C có thể dẫn đến cải thiện kết cục tim mạch.
- Thuốc ức chế CETP (Cholesteryl Ester Transfer Protein): Các thuốc này có thể làm tăng HDL-C tới 100% ở các bệnh nhân có nồng độ HDL-C thấp. Tuy nhiên, chúng chưa chứng minh được hiệu quả trên các bệnh tim mạch. Hiện nay không còn thuốc nào trong nhóm này được sử dụng trên lâm sàng.
- Statin: Statin có thể làm tăng HDL-C 5-10%.
- Fibrate: Các fibrate làm tăng HDL-C với mức độ tương tự Statin, khoảng 5-15%.
Phẫu thuật và thủ thuật
- Can thiệp mạch vành qua da (PCI): Thủ thuật này còn được gọi là nong mạch vành và đặt stent, giúp tái thông động mạch bị tắc. Nếu không có vấn đề gì bất thường, stent sẽ được đặt trong lòng mạch đến cuối đời.
- Cắt bỏ nội mạc động mạch: Đôi khi mảng xơ vữa tích tụ phải được phẫu thuật loại bỏ khỏi thành của động mạch bị hẹp.
- Liệu pháp tiêu sợi huyết (ví dụ: Alteplase): Thường được sử dụng trong cấp cứu nhồi máu cơ tim cấp có ST chênh lên (STEMI) hoặc đột quỵ não thể nhồi máu, giúp tái thông động mạch nuôi dưỡng tim hoặc não ngay lập tức, tránh nguy hiểm đến tính mạng bệnh nhân.
- Phẫu thuật bắc cầu động mạch vành: Đây là một phẫu thuật mở, một mạch máu khỏe mạnh từ bộ phận khác của cơ thể sẽ được sử dụng để tạo đường vòng quanh động mạch bị tắc, thay đổi hướng dòng máu. Đường vòng đôi khi cũng có thể được làm từ vật liệu tổng hợp.
Dự phòng
Một lối sống lành mạnh sẽ giúp giảm thiểu nguy cơ mắc xơ vữa động mạch:
- Chế độ ăn uống: Ăn uống đầy đủ các nhóm thực phẩm, đảm bảo bổ sung đầy đủ và đa dạng các nguồn protein, lipid và carbohydrate. Không ăn mặn, hạn chế các loại đồ ăn vặt, nước ngọt, bánh kẹo, thức ăn chế biến sẵn hoặc được chiên rán nhiều lần. Hạn chế rượu bia.
- Không hút thuốc lá.
- Tập luyện thể dục thường xuyên, phù hợp với sức khỏe của bản thân.
- Không thức khuya, cố gắng hạn chế các tâm trạng buồn bực, lo âu, tức giận, stress.
Tài liệu tham khảo
Roma Pahwa, Ishwarlal Jialal. Atherosclerosis. StatPearls. 2020.
Available from https://www.ncbi.nlm.nih.gov/books/NBK507799/
Rafieian-Kopaei M, Setorki M, Doudi M, Baradaran A, Nasri H. Atherosclerosis: process, indicators, risk factors and new hopes. Int J Prev Med. 2014; 5(8): 927-946.
Available from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4258672/
Bergheanu SC, Bodde MC, Jukema JW. Pathophysiology and treatment of atherosclerosis: Current view and future perspective on lipoprotein modification treatment. Neth Heart J. 2017; 25(4): 231-242. doi: 10.1007/s12471-017-0959-2.
Available from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5355390/
Xem thêm: Mụn viêm: Nguyên nhân, triệu chứng, cách điều trị, dự phòng
