Bài viết dưới đây của Nhà thuốc Bimufa sẽ gửi đến bạn đọc các thông tin đầy đủ vê thuốc WALEROTIC
Thành phần công thức thuốc:
Mỗi viên nang cứng chứa:
Thành phần hoạt chất:
- CefdinirUSP ………………… 300 mg
- Thành phần tá dược. Natri Lauryl Sulfat, Magnesi stearat, Tinh bột natri glycolat, Talc tinh khiết.
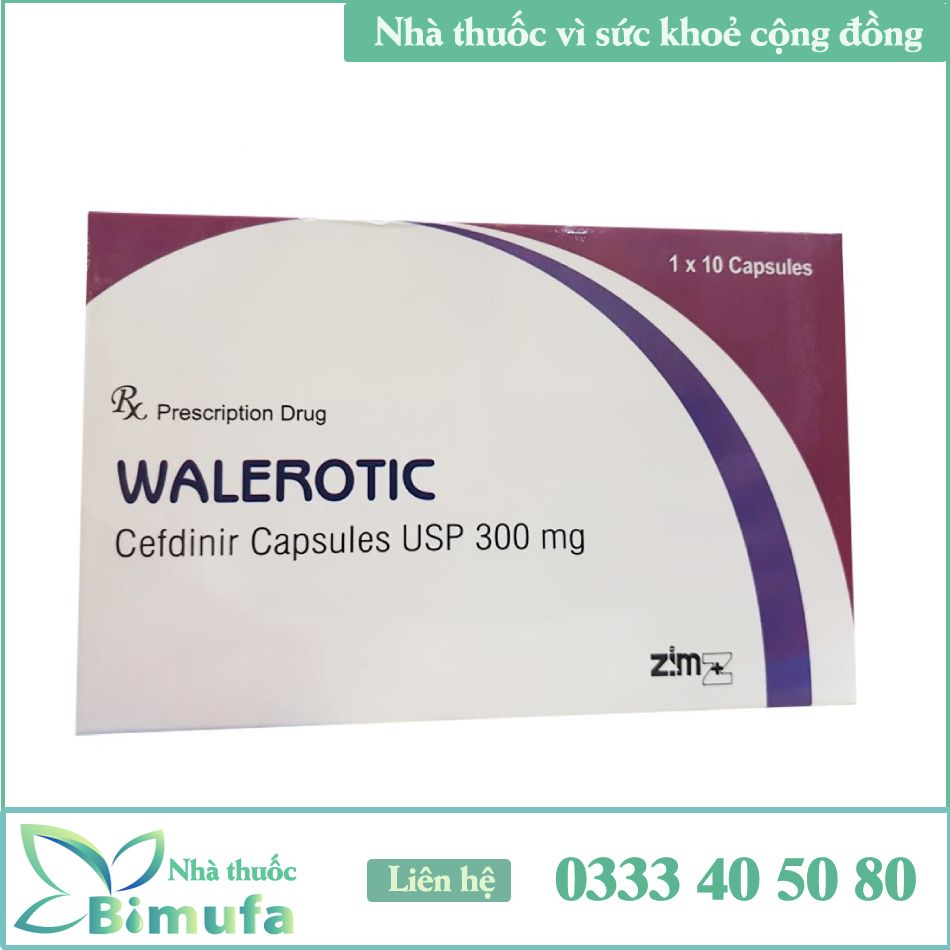
Dạng bào chế: Viên nang cứng (cỡ nang 1) thân nang màu trang, nắp nang màu hồng chứa bột thuốc màu kem.
Chi định của thuốc WALEROTIC
Viên nang cefdinir được chỉ định điều trị cho các bệnh nhân nhiễm trùng mức độ nhẹ đến vừa phải gây ra bởi các chủng vi khuẩn nhạy cảm đã được chỉ định trong các trường hợp được liệt kê dưới đây:
Người lớn và thanh thiếu niên:
Viêm phổi mắc phải cộng đồng do Haemophilus influenzae (kể cả các chủng sản sinh P’lactamase), Haemophilus parainfl uenzae (kể cả các chủng sản sinh p-lactamase), Streptococcus pneumoniae (chì có chủng nhạy cảm penicillin), và Moraxella catarrhalis (kể cả các chùng sản sinh P-lactamase)
Đợt kịch phát cấp tính của viêm phế quản mạn tính do Haemophilus influenzae (kể cả chủng sản sinh p-lactamase), Haemophilus parainfluenzae (bao gồm p-lactamase sản xuất giống), Streptococcus pneumoniae (chỉ có chủng nhạy cảm penicillin), vàMoraxella catarrhal is (kể cả chủng sản sinh p-lactamase).
Viêm xoang hàm trên cấp do Haemophilus influenzae (kể cả chủng sản sinh p-lactamase), Streptococcus pneumoniae (chỉ có chủng nhạy cảm penicillin), vàMoraxella catarrhalis (kê cả chủng sản sinh p-lactamase).
Viêm họng / Viêm amiđan do Streptococcus pyogenes.
Lưu ý: Cefdinir có hiệu quà diệt trừ vi khuẩn s. pyogenes ở vùng hầu họng. Tuy nhiên, cefdinir đã được nghiên cứu để phòng ngừa sốt thấp khớp do s. pyogenes sau điều trị viêm họng/viẻm amiđan. Chì có penicillin tiêm bắp đã được chứng minh có hiệu quả trong ngăn ngừa sốt thấp khớp.
Nhiễm trùng da và cấu trúc da không biến chứng do Staphylococcus aureus (kể cà chủng sản sinh P-lactamase) và Streptococcus pyogenes.
Bệnh nhi:
Viêm tai giữa do vi khuẩn cấp tính Haemophilus influenzae (kê cả chủng sản sinh p-lactamase), Streptococcus pneumoniae (chỉ có chủng nhạy cảm penicillin), và Moraxella catarrhalis (kế cả các chủng sản sinh p-lactamase). Viêm họng/viêm amiđan do Streptococcus pyogenes.
Lưu ý: Cefdinir có hiệu quả diệt trừ vi khuẩn S. pyogenes ở vùng hầu họng. Tuy nhiên, cefdinir đã được nghiên cứu để phòng ngừa sốt thấp khớp do s. pyogenes sau điều trị viêm họng/viêm amiđan. Chỉ có penicillin tiêm bắp đã được chứng minh có hiệu quả trong ngăn ngừa sốt thấp khớp.
Nhiễm trùng da và cấu trúc da không biến chứng do Staphylococcus aureus (kể cả chủng sản sinh p-lactamase) và Streptococcus pyogenes.
LIỀU DÙNG VÀ CÁCH DÙNG
Viên nang:
Liều khuyến cáo và thời gian điêu trị các bệnh nhiễm trùng ỏ’ người lớn và thanh thiêu niên được mô tả trong sơ đô sau; tông liều hàng ngày cho tât cả các bệnh nhiễm trùng là 600 mg. Liêu dùng mỗi ngày một làn trong 10 ngày là có hiệu quả như chia liều 2 lần trong ngày. Liều dùng mỗi ngày một lần chưa được nghiên cửu trong viêm phôi hoặc bệnh da: do đó, viên nang cefdinir nên dùng hai lần mỗi ngày trong các bệnh nhiễm trùng. Viên nang cefdinir có thê uống mà không liên quan đen bữa ăn.
Người lớn và thanh thiếu niên (Tuổi tử 13 trở lên)
| Loại nhiễm trùng | Liều | Thời gian sử dụng |
| Viêm phối mắc phải cộng đồng | 300 mg mỗi 12 giờ | 10 ngày |
| Đợt kịch phát cap của viêm phế quản mạn tính | 300 mg mỗi 12 giờ hoặc | 5 tới 10 ngày |
| 600 mg mỗi 24 giờ | 10 ngày | |
| Viêm cấp tính xoang hàm trên | 300 mg mỗi 12 giờ hoặc | 10 ngày |
| 600 mỗi 24giờ | 10 ngày | |
| Viêm họng/viêm amiđan | 300 mg mỗi 12 giờ hoặc | 5 tới 10 ngày |
| 600 mỗi 24 giờ | 10 ngày | |
| Nhiễm trùng da và cấu trúc da không biến chứng | 300 mg mỗi 12 giờ | 10 ngày |
Trẻ em tuổi từ 6 đến 12 tuổi: Dùng cefdinir ỏ’ dạng hỗn dịch uông.
Sự an toàn và hiệu quả cùa cefdinir cho trẻ em dưó’i 6 tháng chưa được thiết lập.
Bệnh nhân Suy thận:
Bệnh nhân người lớn có độ thanh thải creatinin <30 ml/phút, liều dùng của cefdinir ỉà 300 mg, mỗi ngày một lần.
Độ thanh thài creatinin khó đê đo lường ỏ’ các bệnh nhân ngoại trú. Tuy nhiên, công thức sau đây, có thê được sử dụng để ước tính độ thanh thài creatinin (CLcr) ở bệnh nhân người lớn. Đối với dự đoán có giá trị, nông độ creatinin huyết thanh nên phản ánh mức độ ổn định của chức năng thận.
Nhũng bệnh nhân đang lọc máu:
Chạy thận nhàn tạo loại bỏ cefdinir khỏi cơ thể.ờ những bệnh nhân duy trì chạy thận nhân tạo mạn tính, liêu lượng ban đầu được khuyến cáo là 300 mg hoặc 7 mg/kg liều mỗi ngày.Kết thúc mỗi đợt chạy thận nhân tạo, nên dùng liêu 300 mg (hoặc 7 mg/kg). Những liều tiếp theo (300 mg hoặc 7 mg/kg) sau đó được dùng vào môi ngày khác.
CHỐNG CHỈ ĐỊNH
Cefdinir chống chi định ở các bệnh nhân dị ứng vói các nhóm kháng sinh cephalosporin.
Chống chỉ định cho bệnh nhân dị ứng vói bất cứ thành phần nào của thuốc.
Canh báo và thận trọng khi dùng thuốc:
CÁNH BÁO:
Trước khi điều trị với ceídinir được đặt ra, điều tra cẩn thận để xác định xem bệnh nhân có phản úng mẫn cảm với cefdinir trước đó, cephalosporin, penicilin hoặc thuốc khác. Nếu cefdinir được dùng cho bệnh nhân nhạy cảm với penicillin, càn thận trọng vì xày ra quá mân giữa các kháng sinh p-lactam đã được ghi rõ ràng và có thê xảy ra đên 10% bệnh nhân có tiền sử dị ứng penicillin. Nêu phản ứng dị ứng với cefdinir xảy ra, nên ngưng thuôc. Phản ứng quá mẫn cấp tính nặng có thể cần điều trị với epinephrin và các biện pháp khẩn cấp khác, bao gồm thỏ’ oxy, truyền dịch, tiêm tĩnh mạch kháng histamin, corticosteroid, các amin tăng huyết áp. và kiểm soát đường hô hấp, như được chỉ định trên lâm sàng.
Tiêu chảy liên quan Clostridium difficile (CDAD) đã được báo cáo khi dùng gần như tất cả các thuốc kháng khuấn, bao gồm cefdinir, và có thể dao động trong mức độ nghiêm trọng của tiêu chảy từ nhẹ đến viêm đại tràng gáy tử vong. Điều trị với các tác nhân kháng khuẩn làm thay đổi hệ thực vật binh thường của ruột dẫn đến phát triền quá mức Clostridium difficile.
C.difficile sản sinh độc tố A và B đóng góp vào sự phát triên cùa Clostridium difficilegây tiêu chảy (CDAD). Chủng c. difficile sàn sinh độc lố cao gây tăng tỷ lệ mắc bệnh và tử vong, như các bệnh nhiễm trùng có thể trơ với điều trị kháng sinh và có thể yêu cầu phẩu thuật cắt bỏ ruột kết.CDAD phải được xem xét trong tất cả các bệnh nhân có biểu hiện tiêu chảy sau khi dùng kháng sinh.Tiền sử dùng thuốc cẩn thận là cần thiết vì CDAD đã được báo cáo xảy ra sau khi dùng các tác nhân kháng khuẩnhơn hai tháng.
Nếu CDAD bị nghi ngờ hoặc đã xác định, sử dụng kháng sinh liên tục không chống lại c. difficile có thể cần phải được chấm dứt. Dùng dịch và điện giải thích hợp, bổ sung protein, dùng kháng sinh điều trị c. difficile, và đánh giá phẫu thuật nên được đặt ra như chỉ định lâm sàng.
Thận trọng chung
Dùng cefdinir khi nghi ngờ nhiễm khuân hoặc chưa được chứng minh hoặc chỉ định phòng ngừa không có lợi ích cho bệnh nhân và còn làm tăng nguy CO’ phát triển các vi khuẩn kháng thuốc.
Cũng như với các kháng sinh phổ rộng khác, điều trị kéo dài có thể dẫn đến sự xuất hiện và phát triển quá mức của vi khuẩn đề kháng. Theo dõi cẩn thận các bệnh nhân là rất cần thiết. Neu có bội nhiễm trong khi điều trị, liệu pháp thay thế thích họp nên được dùng.
Cefdinir, cũng như vói kháng sinh phổ rộng khác, nên được kê đơn một cách thận trọng ở những người có tiền sử viêm đại tràng.
ơ bệnh nhân suy thận thoáng qua hay kéo dài (độ thanh thải creatinin <30 ml/phút), tống liều hàng ngày của cefdinir nên giảm vì có thể dẫn đến nồng độ cefdinir trong huyết tương cao và kéo dài sau khi dùng các liều khuyến cáo.
Phụ nữ mang thai và cho con bú
Mang thai
Phân loại B cùa thai kỳ:
Cefdinir không gày quái thai ỏ’ chuột cống với liều uống lên đến 1000 mg/kg/ngày (gấp 70 lần liều của người, dựa vào mg/kg ngày, gấp I 1 lần dựa vào mg/m2ngày) hoặc ờ thỏ vói liều uống lên đến 10 mg/kg/ngày (gấp 0,7 lần liều cua người, dựa vào mg/kg/ngày, gấp 0,23 lần dựa vào mg/m2/ngày). Độc tính cùa thỏ mẹ (giảm CO’ thể tăng cân) đã dược quan sát thấy ỏ’ thỏ ở liều dung nạp tối đa 10 mg/kg/ngày mà không có tác dụng phụ đến con cái. Giảm trọng lượng cơ thê xảy ra trong bào thai liều > 100 mg / kg / ngày, và trong chuột con ờ > 32 mg/kg/ngày. Không có ảnh hưởng quan sát thấy trên các thông sô sinh sàn mẹ hay sự sông còn cùa con cái, phát triên, hành vi, hoặc chức năng sinh sản.
Tuy nhiên, chưa có nghiên cứu đầy đủ và có kiểm soát ỏ’ phụ nữ mang thai. Vì các nghiên cứu sinh sản trên động vật không luôn được tiên đoán đáp ứng trên người, thuốc nảy chỉ nên được sử dụng trong khi mang thai khi thật cần thiết.
Các bà me cho con bú
Sau khi dùng liều đơn 600 mg, không phát hiện có cefdinir trong sữa mẹ.
Tác động lên người lái xe, vận hành máy móc
Chưa ghi nhận được báo cáo phàn ứng bất lợi hoặc chua có nghiên cứu nào về ảnh hưởng của thuốc lên khả năng vận hành máy móc, lái tàu xe, người làm việc trên cao và các trường họp khác.
TƯƠNG TÁC THUỐC
Thuốc kháng acid (chứa nhôm hoặc magiê):
Dùng đồng thời viên nang cefdinir 300 mg với 30 mL hỗn dịch Maalox® làm giảm tỳ lệ (Cmax) và mức độ (AUC) cua sự hấp thụ khoảng 40%. Thòi gian để đạt Cmax cũng được kéo dài 1 giờ.Không có ảnh hưởng đáng kê về dược động học cùa cefdinir nếu thuốc kháng ạcid được dùng 2 giò’ trước hoặc 2 giờ sau khi dùng cefdinir.Neu các thuốc kháng acid phải dùng trong quá trình điều trị cefdinir, cefdinir can được uông ít nhât 2 giò’ trước hoặc sau khi uông thuốc kháng acid.
Probenecid:
Cũng như với các kháng sinh p-lactam khác, probenecid ức chế sự bài tiết cefdinir qua thận, dẫn đến tăng khoảng gấp đôi AUC, tàng 54% nồng độ đỉnh trong huyết tưoưg cefdinir, và kéo dài 50% thời gian bán thải rõ rệt.
Bổ sung Sắt và các thực phẩm tăng cường Sắt:
Dùng đông thời cefdinir với trị liệu bổ sung sắt có chứa 60 mg sắt nguyên tố (như FeSO4) hay vitamin bô sung 10 mg nguyên tô sắt làm giảm mức độ hấp thu 80% và 31 %, tương ứng. Nếu bố sung sắt được yêu cầu trong quá trình điều trị cefdinir, cefdinir can được uống ít nhất 2 giò’ trước hoặc sau khi bổ sung sắt.
Tác dụng cùa các loại thực phàm tăng cường cao có bổ sung sắt nguyên to (chù yếu là ngũ cốc ăn sáng tăng cường chát sát) đối với sự hấp thu cefdinir chưa được nghiên cứu.
Đã có báo cáo về phân hoi có màu đỏ ở bệnh nhân dùng cefdinir.Trong nhiều trường họp, các bệnh nhân cũng đã dùng các sản phẩm có chứa sắt. Màu hơi đỏ là do sự hình thành của một phức họp không hấp thụ giữa cefdinir hoặc các sản phẩm phân hủy cùa cefdinir và sắt trong đường tiêu hóa.
Tương lác thuốc/ Tương tác thử nghiệm phòng thí nghiệm:
Một phản ứng dương tính giả thể keton trong nưó’C tiểu có thế xảy ra với các xét nghiệm sử dụng nitroprussid, nhưng không xây ra với các xét nghiệm sử dụng nitroferricyanid.Diing cefdinir có thể dẫn đến một phản ứng dương tính giả glucose trong nước tiểu khi đang dùng Clinitest®, dung dịch Benedict, hoặc dung dịch Fehling.Khuyen cáo ràng các xét nghiệm glucose dựa trên phàn ứng oxy hóa glucose enzym (như Clinistix® hoặc Tes-Tape®) được sử dụng.Cephalosporin được biết đôi khi gây ra phép thừ Coomb trực tiếp dương tính.
Tác dụng không mong muốn
Các thử nghiệm lâm sàng — Viên nang cefdinir (Bệnh nhân người lớn và vị thành niên)
Trong các thử nghiệm lâm sàng, 5093 bệnh nhân người lớn và thanh thiếu niên (3841 người Mỹ và 1252 không phải người Mỹ) được diều trị vó’i liều khuyến cáo viên nang cefdinir (600 mg/ngày). Hau hết các tác dụng phụ đêu nhẹ và tụ’ khỏi. Không có trường họp tử vong hoặc tàn tật vĩnh viễn do cefdinir. Một trăm bốn mươi bảy trong sô cùa 5093 (3%) bệnh nhân ngưng thuốc do có thể có tác dụng phụ được đưa ra bới các nhà điều tra, có lẽ, hoặc chăc chăn liên quan đến liệu pháp cefdinir. Việc ngưng thuốc chủ yếu do các rối loạn tiêu hóa, thường bị tiêu chảy hoặc buôn nôn. Mười chín trong số 5093 (0,4%) bệnh nhân đã ngưng thuốc do phát ban cho rằng đã liên quan đến dùng cefdinir.
Tại Mỹ, các tác dụng phụ sau đây đã được đưa ra bời các nhà điều tra, có lẽ, hoặc chắc chắn liên quan đến viên nang cefdinir trong các thử nghiệm lâm sàng đa liều (N = 3841 bệnh nhân được điều trị cefdinir):
LƯU Ý: Trong cả hai bệnh nhân dùng cefdinir và bênh nhàn kiêm soát điêu trị, tỷ lệ tiêu chảy và phát ban cao hơn ở bệnh nhi nhỏ tuổi nhất. Tỷ lệ mắc bệnh tiêu chảy ở bệnh nhân được điều trị cefdinir < 2 tuổi là 17% (95/557) so với 4% (51/1226) ở’ bệnh nhàn được điêu trị cefdinir > 2 tuôi. Tỳ lệ mắc phát ban (phát ban do hàm tã chù yêu ỏ’ bệnh nhân trẻ) là 8% (43/557) ỏ’ bệnh nhân < 2 tuổi so vói 1% (8/1226) bênh nhân > 2 tuồi.
Thay đổi các giá trị xét nghiệm sau đây có ý nghĩa lâm sàng có thế, bất kê môi liên quan với điêu trị với cefdinir, đã được nhìn thấy trong các thử nghiệm lâm sàng được tiến hành tại Mỹ:
Thay đối các giá trị xét nghiệm trong thử nghiệm lâm sàng đã được quan sát thấy khi dùng hỗn dịch cefdinir tại Mỹ ở trẻ em.
Kinh nghiệm sau khi lưu hành thuốc:
Tác dụng phụ và các xét nghiệm thay đổi sau đây, bất kê mối quan hệ cùa họ vói cefdinir, đã được báo cáo trong suốt quá trình sử dụng thuốc rộng rãi, gây tử vong, phù nề trên mặt và thanh quản, cảm giác nghẹt thở, phản ứng giống bệnh huyết thanh, viêm kết mạc, viêm miệng, hội chứng Stevens-Johnson, hoại tử biểu bì độc tính, viêm da tróc vảy, ban đỏ đa dạng, ban đỏ nốt, viêm gan cấp tính, ứ mật, viêm gan bạo phát, suy gan, vàng da, tăng men amylase, viêm ruột cấp tính, tiêu chảy ra máu, viêm đại tràng xuất huyết, đại tiện máu đen, viêm đại tràng giả mạc, giảm toàn thể huyết cầu, giảm bạch cầu hạt, giảm bạch cầu, giâm tiểu cầu, ban xuất huyết giảm tiều câu tự phát, thiếu máu tan huyết, suy hô hấp cấp tính, cơn hen suyễn, viêm phối do thuốc, viêm phối tăng bạch cầu eosin, viêm phối kẽ tự phát, sốt, suy thận cấp, bệnh thận, xu hướng chảy máu, rối loạn đông máu, đông máu rải rác nội mạch, chay máu tiêu hóa trên, loét dạ dày, tắc ruột, mất ý thức, viêm mạch dị ứng, tương tác cefdinir-diclofenac có thê, suy tim. đau ngực, nhồi máu CO’ tim, tăng huyết áp, cừ động vô thức, và tiêu CO’ vân.
Tác dụng phụ thuộc lớp cephalosporin:
Các tác dụng phụ và các xét nghiệm thay đổi sau đây đã được báo cáo đôi vói các kháng sinh lóp cephalosporin nói chung:
Phàn ứng dị ứng, sốc phản vệ, hội chứng Stevens-Johnson, hồng ban đa dạng, hoại tử biểu bì độc tính, rối loạn chức năng thận, bệnh thận độc tính, rối loạn chức năng gan bao gồm chứng ứ mật, thiếu máu bất sản, thiếu máu tan huyết, xuất huyết, xét nghiệm dương tính giả glucose niệu, giảm bạch cầu, giảm toàn thể huyết cầu, và mất bạch câu hạt. Triệu chứng viêm đại tràng già mạc có the bắt đầu trong khi hoặc sau khi điều trị kháng sinh.
Một số cephalosporin đã dược liên quan gây ra co giật, dặc biệt ở những bệnh nhân suy thận khi liều lượng không giám. Neu co giật do điều trị thuốc xảy ra, nên ngưng thuốc. Điều trị chống co giật có thế được đưa ra nêu có chỉ định làm sàng.
Thông báo cho bác sỹ hoặc dược sỹ những phản ứng có hại gặp phải khi sử dụng thuốc.
Quá liều và cách xử trí
Quá liều:
Thông tin về quá liều cefdinir ở người chưa có sẵn. Trong các nghiên cứu độc tính cấp trên động vật gặm nhàm, uống liều duy nhất 5600 mg/kg không có lác dụng phụ. Dấu hiệu và triệu chửng độc hại sau quá liều vói kháng sinh Beta- lactam khác bao gồm buôn nôn, nôn, đau thượng vị, tiêu cháy và co giật.
Cách xử trí khi dùng thuốc quá liều: Chạy thận nhân tạo loại bô cefdinir khỏi cơ thể. Điều này có thê hữu ích trong trường hợp có phàn ứng độc hại nghiêm trọng từ quá liêu; đặc biệt nêu chức năng thận bị tôn thương.
Đặc tính dược lực học:
Nhóm dược lý: Thuốc kháng sinh thuộc nhóm cephalosporin thè hệ 3. Mã ATC: JOI DD15
Hoạt tính kháng khuẩn: Cefdinir có phổ kháng khuẩn rộng chống lại vi khuẩn gram dương và gram âm. Đặc biệt, so với các kháng sinh cephem đường uống khác, nó có hoạt tính mạnh chống lại vi khuẩn gram dương như Staphylococcus và Streptococcus spp. Cơ chế hoạt động cùa nó là diệt khuẩn và bên vững vó’i beta-lactamase do nhiều vi khuẩn sản sinh ra, do đó có hoạt tính tốt chống lại các vi khuẩn sản sinh p-lactamase.
Cơ chế tác dụng: Cơ chế tác dụng của Cefdinir là ức chế tổng họp thành tế bào. Cefdinir có ái lực cao với protein gắn penicilin (PBP) 1 (la, Ib), 2 và 3, với các vị trí có các hoạt tính khác nhau theo vi khuẩn.
Đổ làm giảm sự phát triển của vi khuẩn kháng thuốc và duy trì hiệu quả của cefdinir và các loại thuốc kháng sinh khác, ccfdinir chi nên sử dụng để diều trị hoặc ngăn ngừa nhiễm trùng gây ra bởi các vi khuân nhạy cảm. Khi thông tin về tính nhạy càm và nuôi cấy dã có sẵn, người ta cần xem xét việc lựa chọn hoặc thay đổi trị liệu đối vói vi khuân đề kháng. Trong trường họp không có các dữ liệu đó, mô hình về tính nhạy cảm và dịch tễ học địa phương có thê đóng góp vào sự lựa chọn theo kinh nghiệm điều trị.
Đặc tính dược động học:
Hấp thu
Sinh khả dụng dường uống:
Nồng độ cefdinir trong huyết tương tối đa xảy ra từ 2-4 giờ sau dùng viên nang hoặc hỗn dịch cefdinir. Nông độ cefdinir trong huyết tương tăng so vói liều lượng, nhưng tăng ít hơn so vói tỷ lệ liều dùng từ 300 mg (7 mg/kg) đến 600 mg (14 mg/kg). Sau khi dùng hỗn dịch cho người lớn khỏe mạnh, sinh khả dụng cefdinir là 120% so với viên nang. u’ớc tính sinh khả dụng của viên nang cefdinir là 2 1% dùng một liều viên nang 300 mg, và 16% sau khi uông một liều viên nang 600 mg. Ước lính khả dụng sinh học tuyệt đối của hỗn dịch cefdinir là 25%. Hỗn dịch uống cefdinir 250 mg/5 ml đã được chứng minh là tương đương sinh học vó’i nồng độ 125mg/5ml ỏ’ người lớn khỏe mạnh uống lúc đói.
Anh hưởng của thức ăn:
Các Cmax và AƯC của viên nang cefdinir bị giảm 16% và 10%, tương ứng, khi uống với thức ăn nhiều chất béo. ớ người lớn uống hỗn dịch 250 mg/5 ml vói bữa ăn nhiều chất béo, các Cmax và AUC của cefdinir giảm 44% và 33%, tương ứng. Độ lớn của việc giảm này không có khả năng có ý nghĩa lâm sàng bởi vì các nghiên cứu an toàn và hiệu quá cùa hỗn dịch uống cho bệnh nhi đã được tiến hành mà không quan tâm đến hức ăn. Do đó, cefdinir có thể uống má không liên quan đèn thức ăn.
Viên nang cefdinir.
Nồng độ trong huyết tương cefdinir và các giá trị thông số dược động học sau khi uống liều đơn cefdinir 300 và 600 mg ở các đối tượng người lớn được thê hiện trong bảng sau:
| Liều | Cmax | Tmax | AUC |
| (incg/mL) | (giò-) | (mcg X giờ/mL) | |
| 300 mg | 1,60 | 2,9 | 7.05 |
| (0,55) | (0,89) | (2.17) | |
| 600 mg | 2,87 (1,01) | 3,0 (0,66) | 11,1
(3,87) |
Các giá trị thông số dưọc động học của cefdinir trong huyết tương trung bình (± SD) sau khi uông viên nang ỏ’ các đối tượng nguôi lỏn
Dùng nhiều liều:
Cefdinir không lích tụ trong huyết tương sau khi dùng một lần hoặc hai lần mỗi ngày cho các đối tượng có chức năng thận bình thường.
Phân phối
Thể tích phàn phối trung bình (Vdarca) của cefdinir ỏ- người trường thành là 0,35 lít/kg (± 0,29); ở trẻ em (từ 6 tháng tuổi đến 12 tuổi), cefdinir Vdarea là 0,67 lít/kg (± 0,38). 60% đến 70% cefdinir gắn kết với protein huyết tương ở cà người lớn và trẻ em; gan kết không phụ thuộc nồng độ.
Bỏng da:
Trong các đối tượng người lớn, nồng cefdinir trong dịch của bỏng rộp da trung bình (khoảng) tối đa là 0,65 (0,33- 1,1) và 1,1 (0,49-1,9) mcg /ml dã được quan sát 4-5 giờ sau khi uống các liều 300 và 600 mg, tương úng. Giá trị Cmax và AUC (O-oo) cúa bỏng rộp da trung bình là 48% (± 13) và 91% (± 18) cùa các giá trị trong huyết tương tương ứng.
Trong mô amidan: ở nhũng bệnh nhân người lớn trải qua cắt amiđan tự chọn, nồng độ cefdinir trong mô amidan lương ứng 4 giò’ sau khi uống liều đơn 300 và 600 ing trung bình là 0.25 (0,22-0,46) và 0,36 (0,22-0,80) mcg/g. Nông độ trong mò amidan có nghĩa là 24% (± 8) tương ứng vó’i nông độ trong huyêt tương.
Trong mô xoang:
ớ những bệnh nhân người lớn trài qua phẫu thuật xoang hàm trên và xoang sàng tự chọn, nồng độ cefdinir mô xoang trung bình tương ứng 4 giờ sau khi uống liều đơn 300 và 600 mg là <0.12 (<0.12-0,46) và 0,21 (<0,12-2,0) mcg/g. Nồng độ trong mô xoang có ý nghĩa là 16% (± 20) tương ứng vói nông độ trong huyêt tương.
Mô phôi:
ớ những bệnh nhân người lớn trải qua soi phế quản chân đoán, nồng độ cefdinir niêm mạc phế quản trung binh tương ứng 4 giò’ sau khi uống liều đơn 300 và 600 mg là 0,78 (<0,06-1,33) và 1,14 (<0,06-1,92) incg/ml, và là 31% (± 18) tương ứng nồng độ trong huyết tương. Nồng độ dịch lót biểu mô trung bình tương ứng là 0,29 (<0,3-4,73) và 0,49 (<0,3-0,59) mcg/ml, và là 35% (± 83) tương ứng nông độ trong huyết tương.
Dịch ở tai giữa:
Trong 14 bệnh nhi bị viêm tai giữa cấp do vi khuẩn, nồng độ cefdinir trong dịch tai giữa trung bình tương ứng 3 giờ sau uống liều đon 7 và 14 mg/kg là 0,21 (<0,09-0,94) và 0,72 (0,14-1,42) mcg/mL. Nồng độ trong dịch tai giữa có ý nghĩa là 15% (± 15) tương ứng nồng độ trong huyết tương.
Dữ liệu về thâm nhập cefdinir vào dịch não tủy của nguời chưa có sẵn.
Chuyển hóa và thải trừ
Cetdinir không chuyến hóa đáng kể. Hoạt động chủ yếu là do thuốc gốc. Cefdinir được thải trừ chủ yếu qua bài tiết thận vói nứa đời thài trừ huyết tương trung bình (tự) là 1.7 (± 0,6) giờ. Ở người khỏe mạnh có chức năng thận bình thương, Độ thanh thài thận là 2,0 (± 1,0) ml/phút/kg, và độ thanh thài đường uống rõ rệt là 11,6 (± 6,0) và 15,5 (± 5.4) ml/phút/kg sau các liều 300 và 600 mg, tương ứng. Có nghĩa là phần trăm cùa liều hồi phục dưới dạng không dồi trong nước tiếu sau các liều 300 và 600 mg là 18,4% (± 6,4) và 11,6% (± 4,6), tương ứng. Độ thanh thải cefdinir giảm ờ bệnh nhân rối loạn chức năng thận. Bởi vì bài tiết qua thận là con đường thải trừ chù yếu, liều dùng nên được điều chỉnh ở bệnh nhân có chức năng thận bị tốn hại đáng kê hoặc những người đang trải qua chạy thận nhân tạo. Bệnh nhân đặc biệt:
Bệnh nhân Suy thận:
Dược động học cefdinir được nghiên cứu trong 21 đối tượng người lởn vói mức độ chức năng thận khác nhau.Giảm tỷ lệ thài trừ cefdinir, độ thanh thải đường uống rõ rệt (CL/F), và thanh thài của thận là tỷ lệ thuận với việc giảm độ thanh thải creatinin (CLcr).Ket quả là, nồng độ cefdinir huyết tương cao hơn và tồn tại lâu hơn ở những người có suy thận hon ở những người không suy thận.ờ các đối tượng có CLcr giữa 30 và 60 ml/phút, Cmax và t’/z tăng khoảng 2 lần và AUC tăng khoảng 3 lần. Trong các đối tượng có CLcr <30 ml/phút, Cmax tăng khoảng 2 lần, t!4 tang khoảng 5 lần, vả AUG tàng khoảng 6 lần. Điều chỉnh liều lượng được khuyến cáo ỏ’ những bệnh nhân có chức năng thận bị tốn hại đáng kè (độ thanh thài creatinin <30 ml/phút).
Chạy thận nhân tạo:
Dược động học cefdinir đã được nghiên cứu trong 8 đối tượng người lớn chạy thận nhân tạo. Lọc máu (thòi gian 4 giò’) loại bỏ63% cefdinir khỏi CO’ thể và làm giảm t’/z rõrệt từ 16 (± 3,5) đến 3,2 (± 1,2) giò’. Điều chinh liều lượng dược khuyến cáo ỏ’ nhóm bệnh nhân này.
Bệnh gan:
Bỏ ĩ vì cefdinir thài trừ chủ yếu qua thận và không chuyên hóa đáng kê, các nghiên cứu trên bệnh nhân suy gan chưa được tiến hành.Dự kiến điều chỉnh liêu lượng sẽ được yêu câu trong nhóm bệnh nhân này.
Bệnh nhân lão khoa:
Ảnh hường cùa tuổi tác trên dược động cefdinir sau một liều duy nhất 300 mg được đánh giá trong 32 đối tượng từ 19-91 tuổi. Nồng dộ cefdinir toàn CO’ thể tăng lên đáng kể ở’ người cao tuổi (N = 16), Cmax 44% và AUG 86%. Sự gia tăng này là do giảm độ thanh thải cefdinir. Thê tích phân phối rõ rệt cũng giảm, do đó không có sự thay đôi đáng kê trong thải trừ t‘/z đã được quan sát (ngưò’1 cao tuổi: 2,2 ± 0,6 giò’ so vói trẻ: 1,8 ± 0,4 giờ). Bỏ’i vì độ thanh thải cetdinir đã được chứng minh là có liên quan chủ yếu đến những thay đồi trong chức năng thận hơn là tuổi, bệnh nhân lớn tuổi không cần điều chình liều trừ khi họ đã bị tổn hại đáng kể chức năng thận (độ thanh thải creatinin <30 ml/phút).
Giói tính và chúng tộc:
Các kết quà cùa một phân tích tổng họp cùa dược lâm sàng (N = 217) cho thấy không có tác động đáng kể giới tính hay chùng tộc trên dược động học cefdinir.
Vi sinh vật học:
Như vói các cephalosporin khác, hoạt động diệt khuẩn cùa cefdinir là do ức chế tổng hợp thành tế bào. Cefdinir on định nhò’ vào sự’ hiện diện của enzym (3-lactamase, nhưng không phải tất cà.Ket quả là, nhiều vikhuẩn đề kháng với penicillin và một sô cephalosporin lại nhảy cảm với cefdinir.
Cetdinir đã được chứng minh là có hoạt tính chông lại hâu hết các chùng vi khuân sau.
Vi khuân Gram duo’ng hiếu khí:
Staphylococcus aureus (kê cà các chùng sản sinh P-lactamase)
LƯU Ý: Cefdinir không có hoạt tính chống lại với Staphylococcus đề kháng methicillin.
Streptococcus pneumoniae (chúng chi nhạy cám penicillin)
Streptococcus pyogenes
Vi khuân Gram âm liicu khí:
Haemophilus influenzae (ke cả chủng sản sinh p-lactamase)
Haemophilus parainfluenzae (kê cả các chủng sản sinh p-lactamaẫe)
Moraxella catarrhalis (kế cả các chủng sản sinh p-lactamase)
Các dữ liệu in vivo sau đây có sẵn, nhưng ý nghĩa về lâm sàng cùa chúng chưa rõ.
Ccfdinir biểu hiện ỏ’ nồng độ ức chế tối thiếu in vitro (MIC) của 1 mcg/lít hoặc ít hơn so vói (> 90%) các chủng vi khuẩn sau; tuy nhiên, sự an toàn và hiệu quả của cefdinir trong điều trị nhiễm trừng trên lâm sàng do các vi khuân này chưa được xác định trong các thử nghiệm lâm sàng đầy đủ và được kiểm soát tốt.
Vi khuân gram dtrơiig /lieu khỉ:
Staphylococcus epidermidis (chủng chì nhạy cảm methicillin)
Streptococus agalactiae
Nhóm Viridan streptococci
LƯU Ý: Cefdinir không có hoạt tính chống lại các loài Staphylococcus kháng methicillin và Enterococcus.
Các vi khuân Gram âm hiếu khí:
ữtrobacler diver SUS
Escherichia coll
Klebsiella pneumoniae
Proteus mirabilis
LƯU Ý: Cefdinir không có hoạt tính chống lại các loài Pseudomonas và Enterobacter.
Các thử nghiệm tính nhạy căm
Kỹ thuật pha loãng:
Phương pháp định lượng được sừ dụng để xác định nồng độ ức chế tôi thiêu kháng khuân (MIC). Những MIC này cho biết các ước lính về tính nhạy cảm của vi khuẩn với các họp chất kháng khuân. Các MIC nên được xác định bằng cách sử dụng quy trình chuẩn hóa. Quy trình chuẩn hóa này được dựa trên một phương pháp pha loãng(l) (nước dùng hoặc agar) hoặc, tương, dương vói nồng độ cấy chuân và nông độ tiêu chuân hóa cùa bột cefdinir. Các giá trị MIC nên đuợc diễn giải theo các tiêu chí sau:
Đối với vi sinh vật khác Haemophilus spp.
“Những tiêu chuẩn diễn giải này chì áp dụng cho thử nghiệm nhạy cảm vi pha loãng nước dùng vó’i Haemophilus spp. sử dụng Thử nghiệm Trung bình Haemophilus (HTM).
Hiện tại chưa có dữ liệu về chùng kháng điêu này loại bõ bất kỳ kết quà não khắc ngoài “Nhạy cảm”. Chùng có kêt quà MIC gọi là loại “không nhụy cam” nên được gửi đến phòng thi nghiệm cho thư nghiệm thêm.
Đôi vói Streptococcus spp.:
Streptococcus pneumoniae mẫn cảm vói penicillin (MIC < 0,06 mcg/ml), hoặc Streptococcus khác hon là s. pneumoniae mẫn cảm vói penicillin (MIC <0,12 mcg/ml), có thê được coi là nhạy cảm vói cefdinir. Thử nghiệm cefdinir ngược vói các phân lập kháng penicillin hoặc trung gian penicillin là không khuyến cáo.Tiêu chí diễn giải đáng tin cậy cho cefdinir chưa có sẵn.
Một báo cáo về “Tính nhạy câm” chi ra rang các tác nhân gây bệnh có thể bị ức chế nếu các họp chất kháng khuẩn trong máu đạt đến nồng độ thường đạt được. Một báo cáo về “Tính trung gian” cho thây kết quà được xem là chưa rõ rang, và, nếu các vi sinh vật không nhạy cam hoàn toàn dêthay thê, các thuòc có tính khả thi về mặt lâm sàng, các thừ nghiệm cần được lập đi lặp lại. Phân loại này hàm ý áp dụng lâm sàng có thê có trong cácvị trí cùa cơ thê, nơi thuôc tập trung vè mặt sinh lý học hoặc trong tình huống mà liều cao thuốc có thê được sử dụng. Phân loại này cũng cung cấp một vùng đệm, giúp ngăn chặn các yêu tố kỹ thuật nhò không kiêm soát được do gây ra sự khác biệt lớn trong việc diễn giải. Một báo cáo cùa “Đe kháng” cho thấy rằng các tác nhân gây bệnh không thế bị ức chê nêu các họp chất kháng sinh trong máu đạt đến nồng độ thường đạt được; Liệu pháp khác cần được lựa chọn.
Quy trình kiểm tra tính nhạy cảm được tiêu chuẩn yêu cầu sử dụng cùa các vi sinh vật kiêm soát trong phòng thí nghiệm đẻ kiêm soát các khía cạnh kỹ thuật cùa phòng xét nghiệm. Bột cefdinir chuân cung câp các giá trị MIC sau
Kỹ thuật khuếch tán
Phương pháp định lượng cân đo đường kính vùng cũng cung cấp các ước tính thích họp tính nhạy cảm .của vi khuẩn vói các hợp chất kháng khuẩn. Một thủ tục tiêu chuẩn như vậy(2) đòi hỏi phải sử dụng nồng độ cấy tiêu chuẩn. Quy trình này sử dụng đĩa giây tâm ceídinir 5 mcg đê kiêm tra SỊ1′ nhạy cảm cùa vi khuân đối vói cefdinir.
Các báo cáo từ các phòng thí nghiệm cung cấp các kết quà của các thứ nghiệm tính nhạy cảm đơn đĩa chuẩn với một đĩa ceídinir 5 liìg nên được diễn giãi theo các tiêu chí sau:
Sự phân lập cùa Streptococcus pneumoniae nên được kiêm tra trái ngược với một đĩa oxacillin 1 mcg.
Phân lập với kích thước vùng oxacillin > 20 mm là nhạy cảm với penicillin và có thê được coi là nhạy cảm với cefdinir. Streptococcus khác s. pneumoniae nên được kiêm tra vói một đĩa với penicillin 10 đon vị. Phân lập kích thước vùng với penicilin> 28 mm là nhạy cảm với penicillin và có thể được coi là nhạy cảm với cefdinir.
Như với các kỹ thuật pha loãng đã chuẩn hóa, phương pháp khuếch tán cần dùng vi khuẩn đối chứng phòng thí nghiêm đê kiêm soát các khía cạnh kỹ thuật của phòng xét nghiệm. Đôi vói kỹ thuật khuyết tán, đĩa cefdinir 5 mcg nên cung câp các đường kính vừng như sau trong các chùng đối chửng chất lượng trong phòng thí nghiệm:
| Vi khuân | Đường kính vùng (mm) |
| Escherichia coll ATCC 25922 | 24-28 |
| Haemophilus influenzae ATCC 49766- | 24-3 1 |
| Staphylococcus aureus ATCC 25923 | 25-32 |
| 8 Khoảng kiêm soát chât lưọng này chí nhạy cảm với /7. influenzae ATCC 49766 dung HTM. | |
Quy cách đóng gói
Quy cách đóng gói: Hộp I vỉ (nhôm- nhôm) X 10 viên nang cứng. Điều kiện bảo quản của thuốc: ỏ’ nhiệt độ dưới 3.0°C, 1ĨÒ’Ỉ Hạn dùng: 36 tháng, kế từ ngày sàn xuất
Tiêu chuẩn chất lượng: USP
Nguồn tham khảo
Tờ hướng dẫn sử dụng thuốc











Đánh giá
Chưa có đánh giá nào.